Hydrogeit Verlag
Fachverlag für Wasserstoff und Brennstoffzellen sowie für Elektromobilität, Energiespeicherung, Erneuerbare Energie und Alternative Kraftstoffe
Willkommen im Wasserstoff Netzwerk!
Fragen und Antworten zum Thema Wasserstoff und Brennstoffzellen für eine saubere Zukunft.
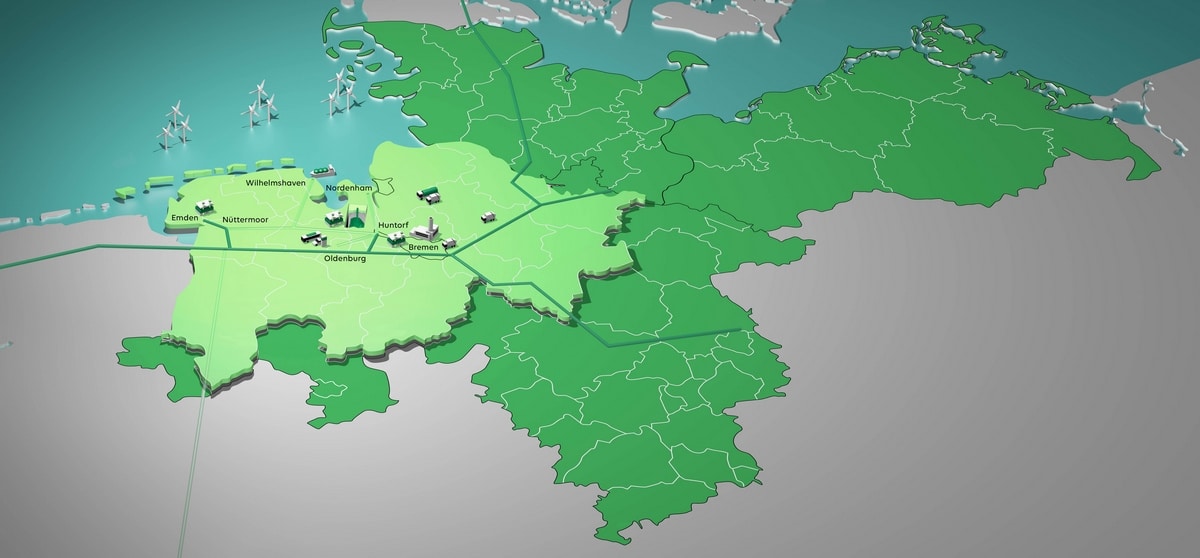
Was ist Wasserstoff und wie wird Wasserstoff hergestellt?
Unabhängige Berichterstattung und detailliertes Wissen für den gesamten H2- und BZ-Sektor | Fachberichte, Meldungen, Termine und Neuigkeiten
Wasserstoff Blog
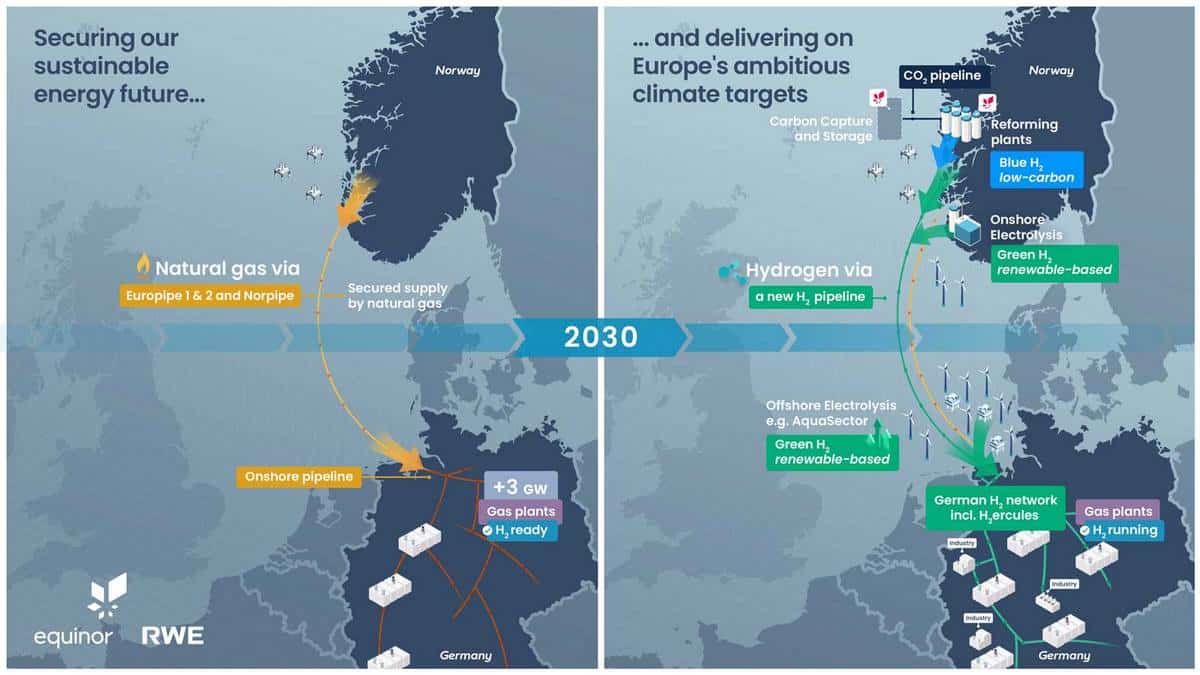
Informieren Sie sich im HZwei-Blog über die neuesten Entwicklungen in der H2- und BZ-Technik sowie in den Bereichen Elektromobilität, Energiespeicherung, Erneuerbare Energien und alternative Kraftstoffe. Der Hydrogeit Verlag bietet Ihnen aktuelle Beiträge und wissenschaftliche Berichte, die Sie auf dem Laufenden halten. Besuchen Sie unseren Blog und bleiben Sie informiert über die spannende Welt von Wasserstoff und Brennstoffzellen.
Wasserstoff Zeitschrift
Hydrogeit Verlag | HZwei Blog & Magazin:
HZwei ist das führende deutschsprachige Magazin für Wasserstoff und Brennstoffzellen, herausgegeben vom Hydrogeit Verlag. Sein englischsprachiges Äquivalent ist das H2-international e-Journal.


Bücher zum Thema Wasserstoff
Im Online-Shop des Hydrogeit Verlags können Sie die neuste Auflage des H2-Klassikers erwerben – gedruckt und digital. Detaillierte Einblicke erlangen Sie in unserer Rubrik „H2-Wissen“, wo Sie alles Probe lesen können.
Newsletter
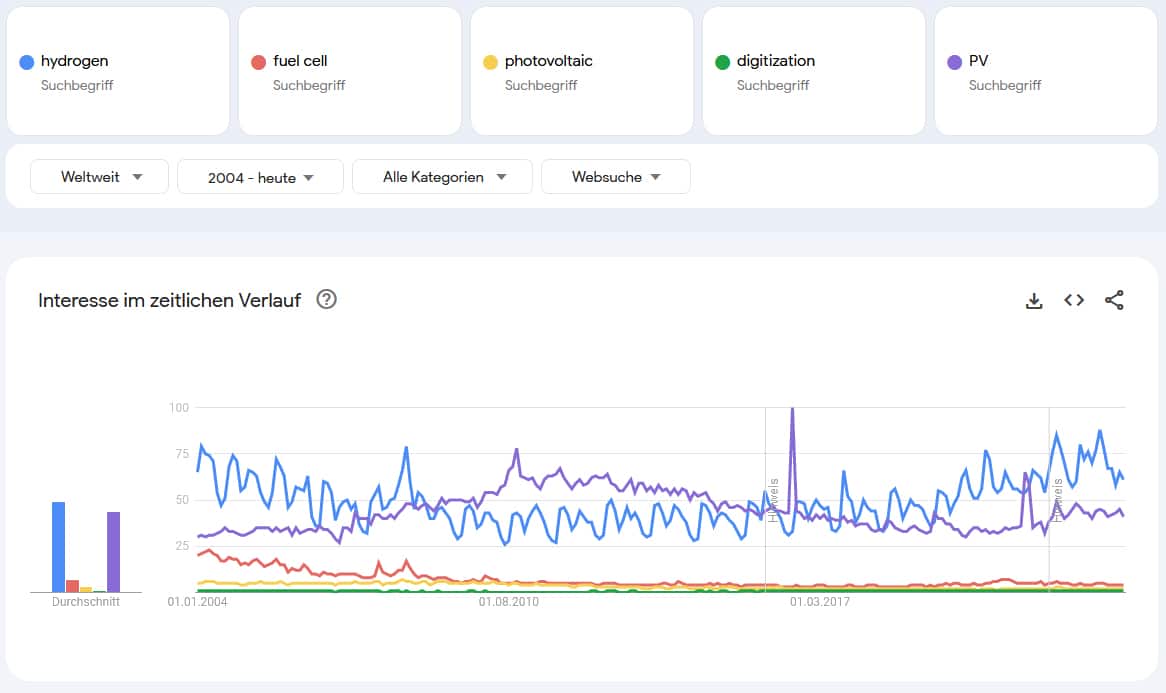
Der HZwei-Newsletter ist eine hervorragende Informationsquelle für alle Neuigkeiten rund um Wasserstoff und Brennstoffzellen, Energiewende, Sektorenkopplung, Power-to-Gas, Dekarbonisierung usw.. Er erscheint regelmäßig kostenlos zum Monatsanfang und hält Sie über die neuesten Entwicklungen in der Branche auf dem Laufenden. Der Newsletter beinhaltet nicht nur fundierte Artikel und Analysen, sondern bietet Ihnen auch Zugriff auf das beliebte Branchenverzeichnis. Abonnieren Sie jetzt den kostenlosen HZwei-Newsletter und verpassen Sie keine wichtigen Informationen mehr! Das englische Pendent ist unserer H2-international-Newsletter.


Termine
Entdecken Sie unseren herausragenden Veranstaltungskalender, der eine Fülle von Möglichkeiten bietet! Informieren Sie sich über Kongresse, Messen, Veranstaltungen und sogar Online-Events, um immer auf dem neuesten Stand zu sein. Unsere Leserschaft und Abonnenten sind die perfekte Zielgruppe. In unserem Online-Kalender finden Sie detaillierte Informationen zu allen relevanten Terminen und direkte Links zu den Veranstaltern. Erfahren Sie mehr über neue Entwicklungen ind bleiben Sie informiert und inspiriert! Für Veranstalter eine perfekte Möglichkeit Veranstaltungen mit detallierten Informationen bekannt zu geben.
Wasserstoff Branchenverzeichnis
Entdecken Sie unser Wasserstoff Branchenverzeichnis, eine umfassende Informationsquelle für Unternehmen, Experten und Enthusiasten der Wasserstoff- und Brennstoffzellenbranche. Hier finden Sie detaillierte Profile von führenden Unternehmen, innovative Technologien und wichtige Akteure in dieser aufstrebenden Industrie. Unser Verzeichnis bietet Einblicke, Kontakte und Ressourcen, die Ihnen helfen, in der Welt des Wasserstoffs erfolgreich zu navigieren. Besuchen Sie unser Branchenverzeichnis und tauchen Sie ein in die Zukunft der sauberen Energie!

Fachverlag für Wasserstoff und Brennstoffzellen sowie für Elektromobilität, Energiespeicherung, Erneuerbare Energie und Alternative Kraftstoffe
Willkommen im Wasserstoff Netzwerk!
Fragen und Antworten zum Thema Wasserstoff und Brennstoffzellen für eine saubere Zukunft.
Was ist Wasserstoff und wie wird Wasserstoff hergestellt?
Unabhängige Berichterstattung und detailliertes Wissen für den gesamten H2- und BZ-Sektor | Fachberichte, Meldungen, Termine und Neuigkeiten
Wasserstoff Blog
Informieren Sie sich im HZwei-Blog über die neuesten Entwicklungen in der H2- und BZ-Technik sowie in den Bereichen Elektromobilität, Energiespeicherung, Erneuerbare Energien und alternative Kraftstoffe. Der Hydrogeit Verlag bietet Ihnen aktuelle Beiträge und wissenschaftliche Berichte, die Sie auf dem Laufenden halten. Besuchen Sie unseren Blog und bleiben Sie informiert über die spannende Welt von Wasserstoff und Brennstoffzellen.
Wasserstoff Zeitschrift
Hydrogeit Verlag | HZwei Blog & Magazin:
HZwei ist das führende deutschsprachige Magazin für Wasserstoff und Brennstoffzellen, herausgegeben vom Hydrogeit Verlag. Sein englischsprachiges Äquivalent ist das H2-international e-Journal.
Bücher zum Thema Wasserstoff
Im Online-Shop des Hydrogeit Verlags können Sie die neuste Auflage des H2-Klassikers erwerben – gedruckt und digital. Detaillierte Einblicke erlangen Sie in unserer Rubrik „H2-Wissen“, wo Sie alles Probe lesen können.
Newsletter
Der HZwei-Newsletter ist eine hervorragende Informationsquelle für alle Neuigkeiten rund um Wasserstoff und Brennstoffzellen, Energiewende, Sektorenkopplung, Power-to-Gas, Dekarbonisierung usw.. Er erscheint regelmäßig kostenlos zum Monatsanfang und hält Sie über die neuesten Entwicklungen in der Branche auf dem Laufenden. Der Newsletter beinhaltet nicht nur fundierte Artikel und Analysen, sondern bietet Ihnen auch Zugriff auf das beliebte Branchenverzeichnis. Abonnieren Sie jetzt den kostenlosen HZwei-Newsletter und verpassen Sie keine wichtigen Informationen mehr! Das englische Pendent ist unserer H2-international-Newsletter.
Termine
Entdecken Sie unseren hervorragenden Veranstaltungskalender mit einer Vielzahl an Möglichkeiten! Informieren Sie sich über Kongresse, Messen, Veranstaltungen und sogar Online-Events, um stets up-to-date zu bleiben. Als perfekte Zielgruppe sind unsere Leserschaft und Abonnenten genau richtig. In unserem Online-Kalender finden Sie detaillierte Informationen zu allen relevanten Terminen und direkte Links zu den Veranstaltern. Erfahren Sie mehr über die spannenden Entwicklungen in der Welt von Wasserstoff und Brennstoffzellen.